Übersicht
Humira ist ein vollständig humanisierter monoklonaler Antikörper. Dies bedeutet, dass, obwohl es in nicht-menschlichen biologischen Systemen hergestellt wird, die tatsächliche Proteinzusammensetzung des Arzneimittels mit der von menschlichen Antikörpern identisch ist. Und dieser ausgezeichnete Humira von dem TNF-Blocker des monoklonalen Antikörpers, der vor ihm genehmigt wurde – seine Proteinzusammensetzung wurde teilweise von einem nicht-menschlichen (Maus) Antikörper abgeleitet.
Im Jahr 2002 wurde Humira erstmals von der US-amerikanischen Gesundheitsbehörde FDA zur Behandlung von rheumatoider Arthritis zugelassen. Es ist eines der verschiedenen biologischen Medikamente, die TNF-alpha blockieren, darunter:
Enbrel (Etanercept): Das erste Anti-TNF-Medikament, das 1998 von der FDA für rheumatoide Arthritis und bestimmte entzündliche Formen der Arthritis zugelassen wurde. Remicade (Infliximab): Der zweite TNF-Inhibitor, der 1999 von der FDA zugelassen wurde.
- Simponi (Golimumab): Zulassung durch die FDA am 24. April 2009.
- Cimzia (Certolizumab Pegol): Zulassung durch die FDA am 14. Mai 2009.
- Dosieren
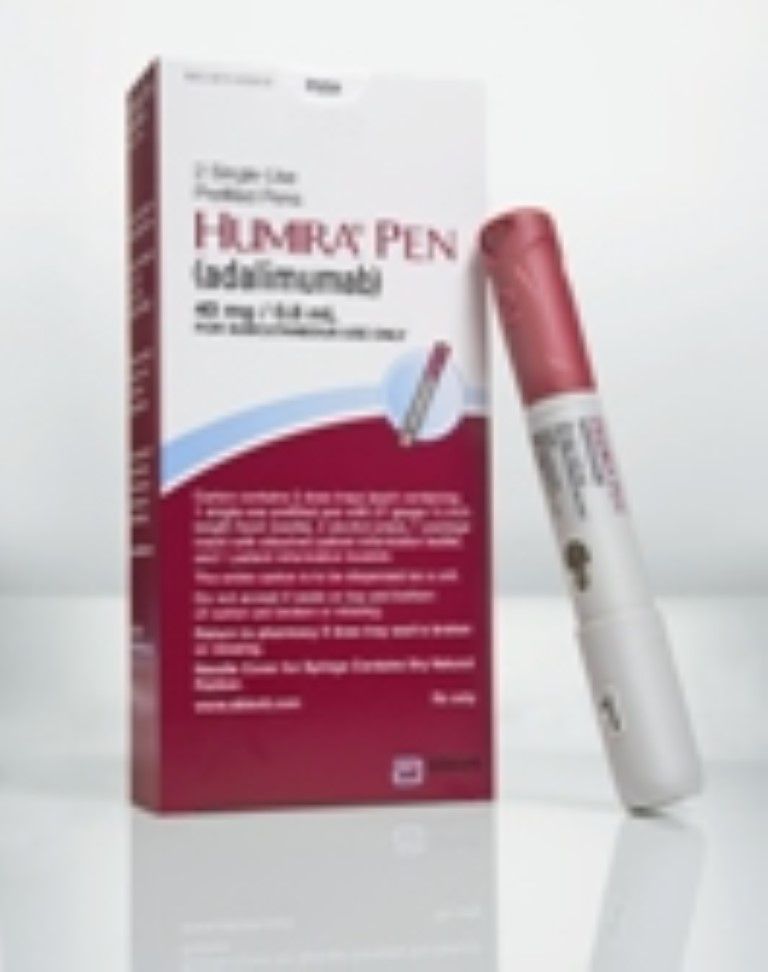
- Humira wird einmal alle zwei Wochen subkutan (unter die Haut) injiziert. Die Patienten können von ihrem Arzt angewiesen werden, jede Woche Injektionen vorzunehmen, wenn nicht alle 14 Tage ausreichend sind.
Es war zuerst in einer Einweg-Fertigspritze erhältlich. Ein Einweg-Einwegsystem wurde ebenfalls entwickelt, das als Humira Pen bekannt ist.
Die empfohlene Dosis beträgt jedoch 40 mg als subkutane Selbstinjektion unter Verwendung der Fertigspritze oder Humira Pen jede zweite Woche. Methotrexat, andere nicht-biologische DMARDs, Glucocorticoide, nichtsteroidale Antirheumatika (NSAIDs) oder Analgetika (Schmerzmittel) können während der Behandlung mit Humira fortgesetzt werden. Andere biologische DMARDs sollten jedoch nicht verwendet werden.
Indikationen
Seit der ersten Zulassung durch die FDA wurden weitere Indikationen für Humira hinzugefügt. Es kann verschrieben werden, um auch zu behandeln:
Rheumatoide Arthritis
Ankylosierende Spondylitis
- Psoriatische Arthritis
- Juvenile idiopathische Arthritis
- Plaque Psoriasis
- Colitis ulcerosa
- Adult und Pediatric Morbus Crohn
- Hidradenitis Suppurativa
- Nebenwirkungen
- Häufige Nebenwirkungen mit Humira assoziiert sind:
Milde Reaktion an der Injektionsstelle
Ausschlag
- Kopfschmerz
- Magenverstimmung oder Übelkeit
- Pneumonie
- Nebenwirkungen
- Da Humira die Immunreaktion im Körper unterdrückt, die normalerweise die Infektion bekämpft, wurde sie mit schweren Infektionen wie Tuberkulose, Sepsis und Pilzinfektionen in Verbindung gebracht . Es kann auch die Symptome von Erkrankungen des Nervensystems verschlechtern (z.B. demyelinisierende Störungen). In klinischen Studien wiesen einige Patienten über einen Zeitraum von 24 Monaten höhere Raten von Krebs und Lymphomen auf.
Wer darf Humira nicht einnehmen? Humira darf nicht bei Patienten mit bekannter Allergie gegen das Arzneimittel oder seine Bestandteile angewendet werden. Es darf auch nicht von Patienten angewendet werden, die schwanger sind oder stillen.
Das Medikament sollte nicht bei Patienten mit einer aktiven Infektion oder bei Patienten, die für eine Infektion prädisponiert sind, verschrieben werden, einschließlich Patienten mit unkontrolliertem Diabetes oder Patienten mit wiederkehrenden Infektionen in der Anamnese.
Sagen Sie Ihrem Arzt
Wenn Sie eine aktive Infektion haben
Wenn Sie mit Hepatitis B infiziert wurden oder ein Träger sind (Humira wurde mit der Reaktivierung von Hepatitis B in Verbindung gebracht)
Wenn Sie Taubheit, Kribbeln oder Multiple Sklerose oder eine Störung des zentralen Nervensystems haben
- Wenn Sie wegen Herzversagens behandelt wurden
- Bevor Sie Impfungen oder Operationen erhalten
- Um vermutete Nebenwirkungen zu melden, wenden Sie sich bitte an AbbVie Inc. at 1-800- 633-9110 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.

